论一例异常红细胞凝集引发的思考
2023-07-13 16:21 文章来源:
作者:郭爱云 胡哲 李海英 王美娟 谢小兵
单位:湖南中医药大学第一附属医院
温故知新
MCV、MCH、MCHC的正常参考范围分别为80-100fl、27-32pg、320-360g/L,依据MCV、MCH、MCHC可进行贫血的形态学四分类。我们知道,红细胞凝集大多有RBC、HCT假性降低,MCV和MCHC的假性升高,但MCHC正常的红细胞凝集又是怎么回事呢?毕竟“巨大红细胞”的正色素性贫血不常见。
先上这例异常的血常规结果(如图1):红细胞(RBC)为0.53×1012/L;血红蛋白(HGB)为31g/L;血细胞比容(HCT)为8.7%;红细胞平均体积(MCV)为163.8fl;平均红细胞血红蛋白含量(MCH)为58.8pg;平均红细胞血红蛋白浓度(MCHC)为359g/L。
很明显,该案例的结果不符合RBC、HCT和HGB之间“三三规则”(即30×RBC≈HGB,0.3×HGB≈HCT),需要引起警惕:
①查看仪器报警信息提示红细胞凝集(如图1),且直方图显示RBC体积分布呈偏态分布,体积跨度为70~300fl左右,右侧有翘起;
②肉眼查看血液标本状态:无凝块,管壁上有细沙状小颗粒凝集(如图2)。
综合推断,提示存在MCV假性升高、RBC和HCT假性降低的情况,虽未推片镜检,该案例符合冷凝集的情况。那如何来验证呢?
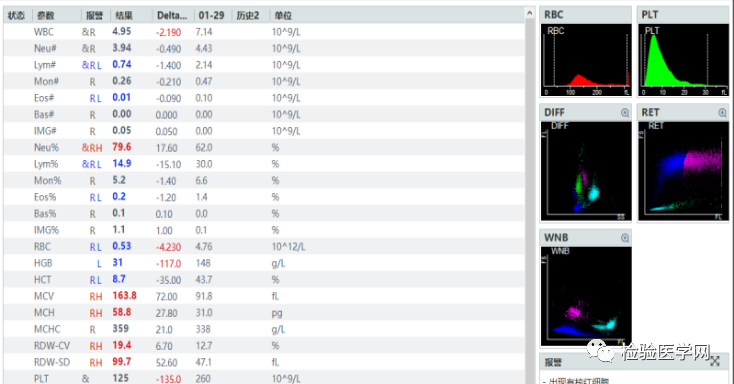
图1 提示红细胞凝集,而1.29(3个月前)为正细胞正色素性贫血

图2 血常规标本有细沙状小颗粒凝集现象
按照操作规程,可采用的纠正红细胞冷凝集的方法有:
1. 温浴法(37℃或41℃水浴)
(1)标本37℃温浴30min后,BC-7500血常规结果(如图3):RBC为0.69×1012/L;Hb为29g/L;HCT为9.8%;MCV为142.9fl;MCH为42.9pg;MCHC为300g/L。
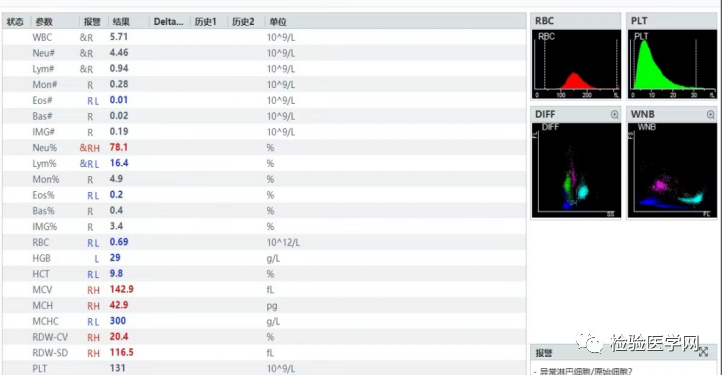
图3 标本37℃温浴30min后
(2)标本37℃温浴60min后,BC-7500血常规结果(如图4):RBC为0.72×1012/L;Hb为31g/L;HCT为10.4%;MCV为145.0fl;MCH为43.5pg;MCHC为300g/L。
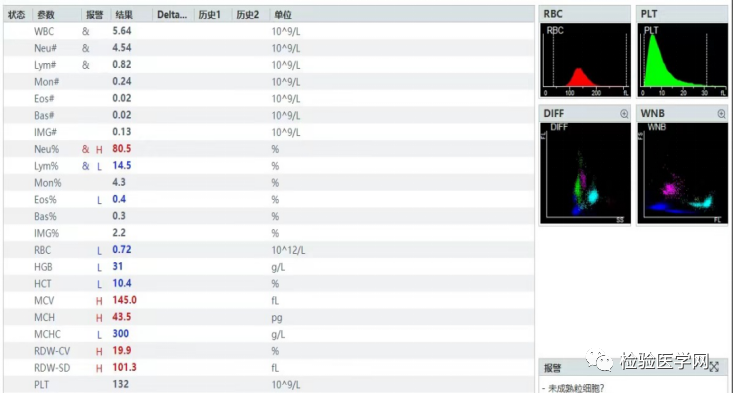
图4 标本37℃温浴60min后
2. 血浆置换法
将血常规标本以3000r/min离心5min后,将加样枪缓缓将上层血浆吸出,并记录弃去量,再加入适量37℃温浴生理盐水,混匀、3000r/min离心5min后吸弃上清液,同法重复洗涤三遍,最后加入与记录量等量的37℃温浴生理盐水,混匀后立即上机测定。血液经生理盐水洗涤后沙粒附壁现象消失,测定结果如图5。
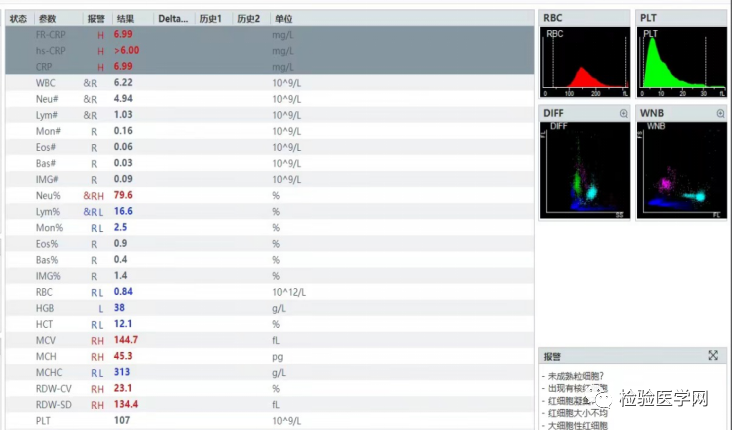
图5 采用生理盐水置换血浆后的测定结果
表1 不同方法之间的对比
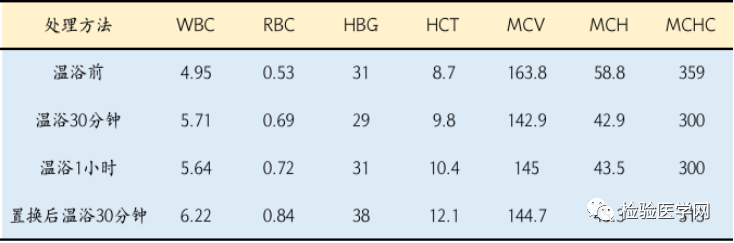
【思考】本案例中红细胞温浴0min、30min、1h后,红细胞“解聚”后RBC计数总数依次增加,MCV、MCH、MCHC均得到改善,说明存在冷凝集现象,但温浴后红细胞仅部分解聚,且MCV依旧呈高值,可能与红细胞被自身抗体致敏相关,而MCHC低于参考范围下限,考虑为低色素性贫血。
血标本温浴1h后比温浴30min后红细胞聚集程度高(MCV不降反增),考虑自身致敏红细胞聚集所致。该案例置换时因最终加入体积不准,以HGB(不变)为标准进行修正后,血浆置换后和温浴后效果无明显统计学差别。
跟临床沟通进一步完善溶血全套、血型单特异性抗体等后,诊断为自身免疫性溶血。而自身免疫性溶血多有诱因,进一步完善自身免疫性抗体相关检查。
3. 查询资料后知,SYSMEX-RET通道的加热和核酸荧光染色法能使冷凝集样本得到纠正(采用激素治疗2天后复查的血标本)
(1)出现频率最高的红细胞体积(R-MFV,RBC-most frequent volume)和光学法参考参数RBC-O联合应用能够方便、快速地计算出冷凝集标本的MCHC[1]:参数R-MFV与MCV相比,无统计学差异,可用R-MFV代替MCV。有研究表明,冷凝集温浴后,RBC-O≈RBC-I。
本案例中,RBC-O结果为:0.9×1012/L(如图6);R-MFV结果为:161.7fL(如图7)。由于冷凝集对HGB影响不大,故HGB结果41g/L可采用:通过计算得出HCT为14.6%,MCH为45.56pg,MCHC为281.8g/L。
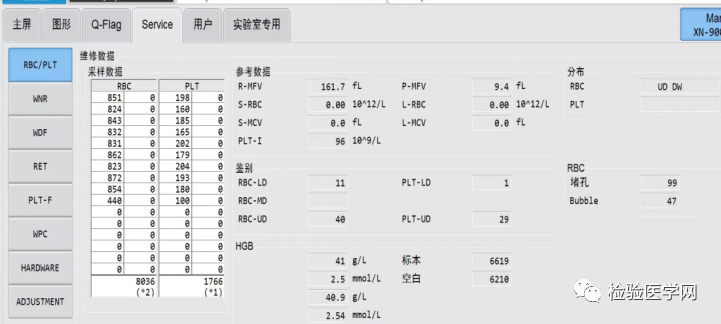
图6 Service界面下RET相关参数RBC-O
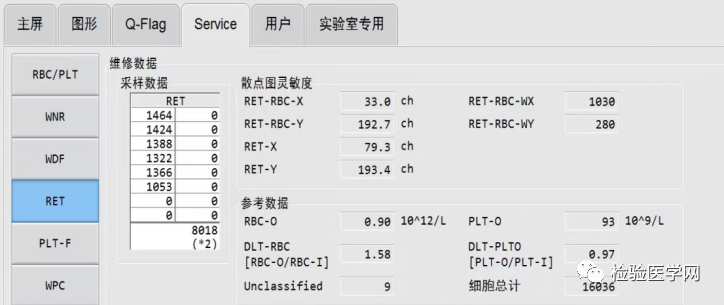
图7 Service界面下R-MFV参数
(2) 利用RET通道的RBC-He结果:RBC-He可作RET通道实测平均红细胞血红蛋白含量。有统计数据表明,RBC-He和MCH的相关性很好,且RBC-He是MCH的0.9201倍。同上,R-MFV可代替MCV,HGB结果为41g/L,通过计算可得出RBC、HCT、MCHC。
同理,利用RET通道的RET-He结果:RBC-He可作RET通道实测平均网织红细胞血红蛋白含量。同上,R-MFV可代替MCV,HGB结果为41g/L,通过计算可得出RBC、HCT、MCHC。
(3) 迈瑞7500温浴后预稀释功能:温浴的血常规标本和温浴的稀释液以20:100稀释后,立即采用预稀释模式检测。
(4)比较SYSMEX-RET通道下几种方法与迈瑞7500温浴后预稀释的相关参数(如表2):
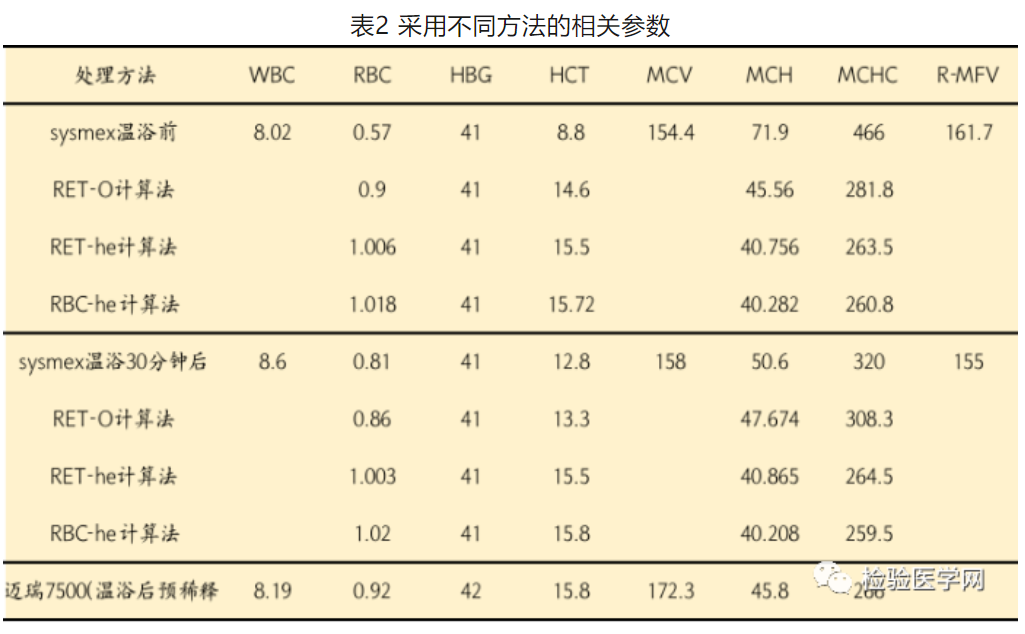
【思考】温浴后RBC、HCT均增加,MCH、MCHC均降低,表明血标本中存在冷抗体。而RBC-he和RET-he比RBC-O呈现了更好的红细胞冷凝集“解聚”结果,且温浴前后无统计学差异,稳定性好。温浴后MCV不降反增,考虑为温抗体所致部分红细胞聚集所致。因此,网织红通道下,冷凝集所致红细胞得到明显“解聚”。不同方法仅供参考。
(5)用激素治疗2天后镜下红细胞凝集情况(如图8-图10):
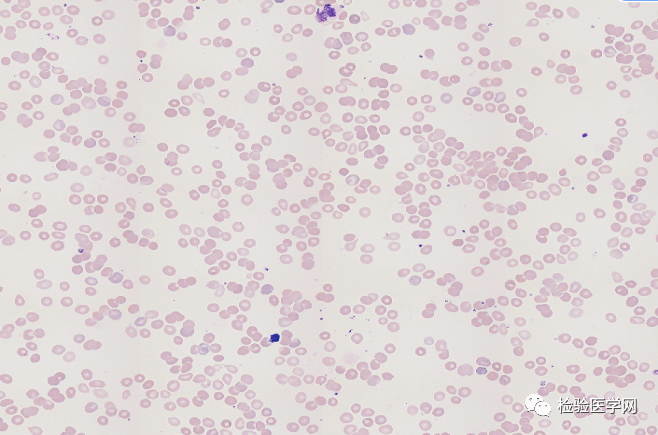
图8 室温下,推片显示治疗后红细胞仍大量聚集,卵圆形细胞增多
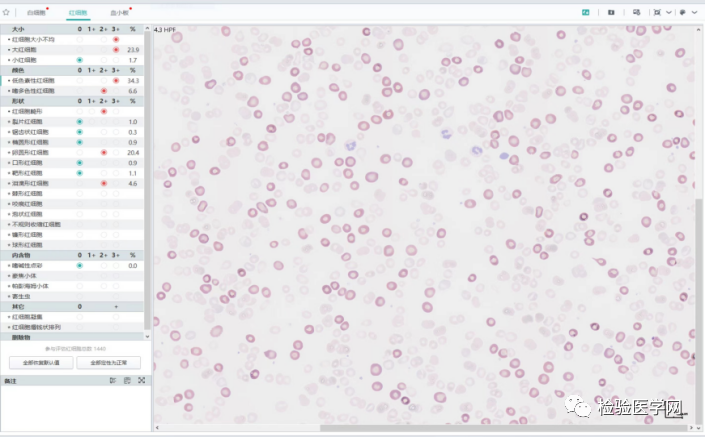
图9 温浴前低色素红细胞占总的红细胞的比例34.3%,大红细胞占21.9%
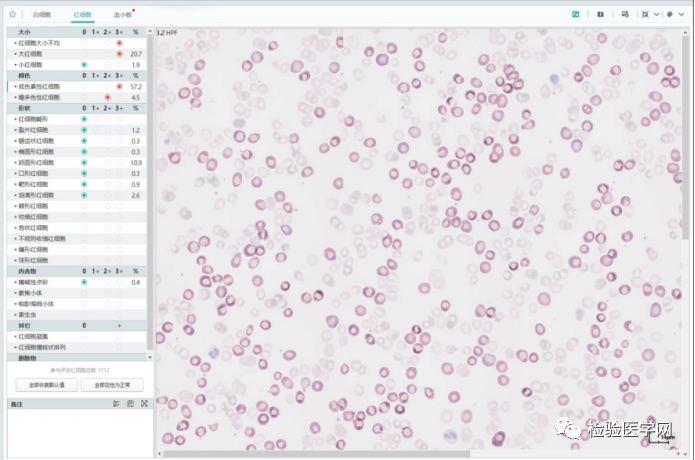
图10 温浴后低色素红细胞占红细胞总数的比例为57.2%,大红细胞占20.7%
【思考】温浴后,镜下红细胞仅部分解聚,考虑为冷抗体和温抗体并存;解聚后镜下低色素红细胞占比增加,考虑大细胞低色素性贫血,与红细胞部分解聚后,MCHC下降至参考范围低限之下相符合。
4. 改良牛鲍血细胞计数法
(1)用温浴的生理盐水将血液进行3-5次的血浆置换,或床旁采血后,按照手工计数法使用温浴生理盐水稀释后在显微镜下计数,计数5个中方格内的RBC约为N个。
RBC=N×5×200×10×106/L=N/100 *1012/L。
(2)将置换后的血再次上机检测HCT(仪器检测值)。
(3)根据计算公式计算其他参数。
案例分析
1. 入病房询问病史:患者为52岁男性,因“无明显诱因出现反复乏力身黄5年余,再发加重10天”入院,无肝脾肿大,既往无类似家族史、无食物和药物过敏史。
【入院后完善检查】
①网织红细胞、胆红素(间接胆红素为主)、LDH等明显升高,溶血检查全套中结合珠蛋白降低,均提示存在血管内溶血,铁蛋白正常、(血管内溶血可致)血清铁升高,排除缺铁性贫血;血型单特异性抗体(IgG+C3)阳性,结果高度提示存在温抗体型自身免疫性溶血性贫血,与患者主诉和症状相符,同时与温浴后红细胞不能完全解聚相符;
②贫血全套:镜下大细胞性贫血,伴叶酸明显降低,考虑巨幼红细胞性贫血;
③进一步完善其他自身免疫性抗体检查:IgG型β2糖蛋白1(IgG-β2GP1)、特异性IgG型抗心磷脂抗体中度升高,抗核抗体、Scl-70均阳性,考虑抗磷脂抗体综合症(antiphospholipid antibody syndrome, APS)。
该患者产生了自身免疫性疾病相关的抗体,与温浴后红细胞部分解聚相符合。因此,该患者诊断考虑为温抗体和冷抗体混合型自身免疫性溶血性贫血。引起红细胞凝集的原因可能有多种,最常见的是由冷抗体引起凝集,而温抗体引起的凝集难发现所以少见,混合型则更少见。
2. 引起红细胞冷凝集的因素[2]有:
①自身免疫性疾病;②支原体感染、传染性单核细胞增多症、自身免疫性溶血性贫血、骨髓瘤等疾病;③低温,秋冬季节为冷凝集高发季节。
因此,温浴或血浆置换是纠正红细胞冷凝集的标准方法[2],但当温浴无法很好“消除”红细胞凝集,而血浆置换操作繁琐、置换易因血细胞成分丢失结果不准的情况下,可考虑采用RET通道研究参数进行计算,提高准确性的同时,能提高效率、缩短门急诊标本TAT时间。
3. 红细胞冷凝集的凝集程度与冷凝集效价呈正相关,主要由IgM型(主)、IgG和IgA型等红细胞自身抗体介导[3]。本案例中,该患者长期反复发生自身免疫性溶血性贫血,合并有抗磷脂抗体综合症,产生大量自身温抗体和冷抗体共同促使红细胞凝集,RBC、HCT假性降低,MCV、MCH假性升高,特别的是假性增高的MCHC在正常参考范围内,温浴处理后红细胞部分解聚,低色素红细胞比例增高,校正后的MCHC低于参考范围下限,提示存在大细胞低色素性贫血。而未校正前的结果为巨细胞高色素性贫血,很容易引导临床误判诊断方向。
4. 结果发布:建议采用纠正后的红细胞及其相关参数结果,并备注凝集。
5、治疗:建议使用激素、免疫抑制剂抑制自身免疫反应,及利妥昔单抗清除抗体,结合中医药利湿退黄等,必要时进行淋巴血浆置换或半全血置换。(因患者经济情况不好,没有做更细的病因筛查。)
【参考文献】
1.血液分析仪RBC-O和R-MFV参数在纠正冷凝集标本MCHC中的作用. 李敏,李建英,罗国菊,郭野. 检验医学[J]. 2022(10):948-951.
2.血常规MCHC对标本性状异常的提示价值及抗干扰方案的探讨. 王莹,单洪丽,曲林琳. 国际检验医学杂志[J]. 2022.2(43):285-289.
3.BerentsenS,MaleckaA,RandenU,eta1.Cold agglutinin disease:where do we stand,and where are we going?[J].clin AdvHematol Oncol. 2020,18(1):35-44.
